摘 要:本次检测中,我们利用商品化ELISA检测试剂盒,对某大型猪场送检的仔猪、母猪和公猪共5个分场的285份血清进行了常规CSF、PRV、PRRSV和PCV的抗体水平检测,结果显示在送检的5个分场中2场的群体抗体水平要高于其他各场;该猪场的整体PRRSV和PCV水平要好于PRV和CSF;母猪和公猪的群体水平高于仔猪。
关键词:猪场;抗体检测;分析
抗体检测是指根据抗原抗体特异结合原理,利用某些方法对样品中的抗体类型和含量进行定性或定量测定的一种技术。该技术能够用于猪场免疫效果监测、免疫方案制定及潜伏感染状态调查等。近年来随着规模化猪场数量的增多,单纯依靠经验进行大规模猪群的日常管理存在极大风险,应该在经验基础上引入更为科学的猪群健康状况评价机制,抗体检测正是一种可以提供除生产数据信息之外,可以直观反映猪群健康状态的有效技术,目前已被很多猪场接受并应用。2013年3月份,我们根据委托对某大型猪场送检的285份血清进行了猪瘟(CSF)、蓝耳病(PRRS)、伪狂犬(PRV)和圆环病毒病(PCV)的抗体检测,并将检验结果结合猪群生产情况与免疫情况进行了分析,找出了当前该场猪群可能存在的风险,并提出了针对性建议。具体检验过程及内容如下:
一、材料与方法
(一)材料
恒温箱、单道及多道移液器(Eppendorf))、全自动酶标仪(Bio Tek)等。
猪瘟抗体检测试剂盒(武汉科前,批号130206:)、伪狂犬gB抗体检测试剂盒(武汉科前,批号130201:)、蓝耳病抗体检测试剂盒(武汉科前,批号130209:)、圆环病毒2型抗体检测试剂盒(武汉科前,批号130202:)。
血清共285份,分别来自5个场(1-5场),其中一场、二场、三场和四场均为60份,五场为45份。
(二)方法
1、PRRSV及PCV的抗体检测过程
根据说明书要求,按如下步骤进行:洗板→加样品及阴阳性对照→温育→洗板→加酶标二抗→温育→洗板→加底物、显色→加终止液、测定。其中检测结果成立的条件为:阴性对照OD<0.3、阳性对照OD≥0.7;PRRSV检测中根据KQ值判断样品的结果,KQ计算公式为:样品OD值/阳性对照OD均值*100,若KQ≥20,则样品为抗体阳性,若KQ<20,则样品为抗体阴性;PCV检测中根据OD值判断样品的结果:若样品OD>0.42,则样品为抗体阳性、若样品OD<0.38,则样品为抗体阴性、若样品0.42≥OD≥0.38,则样品为可疑,应重测。
2、CSF及PRV的抗体检测过程
根据说明书要求,按如下步骤进行:加样品及阴阳性对照→温育→洗板→加酶标二抗(或酶标记物)→温育→洗板→加底物、显色→加终止液、测定。其中检测结果成立的条件为:CSF阴性对照OD<0.3、阳性对照OD≥0.6,PRV阴性OD均值-阳性对照OD均值≥0.4;PRV检测中根据S/N值判断样品的结果,S/N计算公式为:样品OD值/阴性对照OD均值,若S/N≤0.6,则样品为抗体阳性、若S/N>0.7,则样品为抗体阴性、若0.7≥S/N>0.6,则样品为可疑,应重测;CSF检测中根据OD值判断样品的结果:若样品OD≥0.35,则样品为抗体阳性、若样品OD<0.35,则样品为抗体阴性。
二、结果
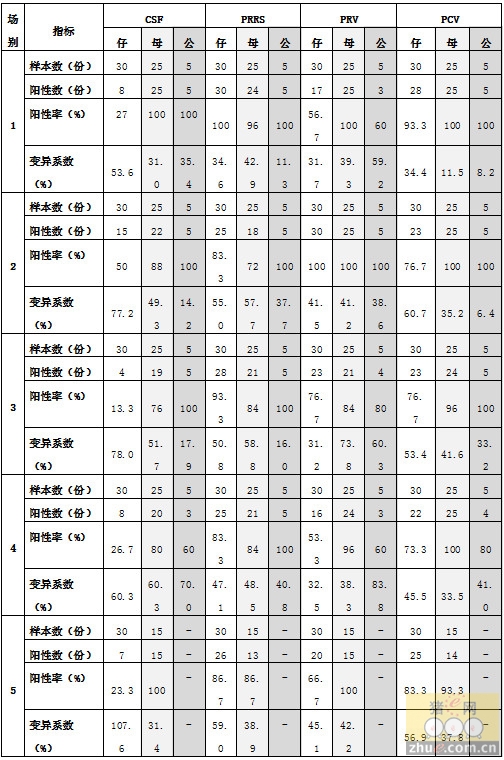
经统计各项检测试验均符合结果成立条件,各场送检样品的检测结果见表1。
表1 1-5场各项目检测结果汇总
三、分析与讨论
(一)检测结果分析
根据猪场提供的免疫程序,其仔猪的免疫方案为:CSF两次(4w和8w)、PRV两次(0d和5w)、PRRSV和PCV各一次(分别为2w和3w);母猪的免疫方案为:CSF一年3次、PRRSV和PRV一年4次、PCV为跟胎免疫(产前一个月);公猪的免疫方案为:CSF、PRV和PRRSV与母猪相同、PCV为初次配种前免疫两次。本次检测时,各场所采血样的猪生产情况分布为:仔猪(保育初期:10头、中期:10头、后期:10头)、母猪(后备:5头、经产空怀:10头(5场为5头)、怀孕:10头(5场为5头)、公猪(配种期:5头(5场无)。
由于本次检测为常规抗体水平监测,所以检测结果仅是对当前猪群抗体水平的反应。从各场结果来看,阳性率和变异系数(CV)方面,四个检测项目综合后排序为2场>1场>3场>4场>5场,其中2场的各项检测指标在不同年龄段猪只中最为稳定,这与猪场人员提供的生产数据信息相吻合,即2场的生产性能最为突出和稳定,究其原因我们认为这与各场的管理方式有很大关系,通过对各场生产过程的了解也印证了这一点。
从各检测项来看,5个场中均为CSF和PRV的阳性率最差,其中1场、3场、4场和5场的仔猪CSF阳性率仅为13%-27%、1场和4场的仔猪PRV阳性率仅为53.3%和56.7%,从仔猪的不同年龄段结果来看,CSF和PRV阴性猪主要集中在保育前期和中期阶段(限于篇幅数据未详细列出)。分析认为,造成这些仔猪CSF和PRV抗体水平低的原因可能主要为母源抗体衰减和免疫时间过晚(经过一免的PRV抗体阳性率要显著高于CSF还未一免和一免后不久的仔猪)。除上述两项外,PRRS和PCV在各场仔猪中检测结果都较好,抗体阳性率均在70%以上,说明产房阶段的免疫刺激机体产生了较好的抗体反应。
根据猪只年龄段来看,本次检测中母猪和公猪的结果好于仔猪,其中检测结果为100%阳性的有:1场母猪CSF、PRV、PCV和公猪CSF、PRRS、PCV检测项;2场母猪PRV、PCV和公猪CSF、PRRS、PRV、PCV检测项;三场公猪CSF、PRRS、PCV检测项;四场母猪PCV、公猪PRRS检测项和五场母猪PRV、PCV检测项。在这些检测结果中,我们发现虽然公猪和母猪的各检测项抗体阳性率均较高,但在抗体整齐度(即CV)方面,仅有PCV项在大部分猪场中可以控制在10%以内,其他均偏高。PRRS项的CV分布在50%左右,说明部分场内母猪和公猪对PRRS疫苗的免疫存在应答方面的差异,提示我们应该对猪群的免疫机能进行调节,使之更趋于一致,从而提供更好的群体抗体保护。同时建议在PRRS疫苗免疫之前,先在饲料中加泰万菌素(治嗽静)以抑制蓝耳病毒的复制,之后再进行疫苗免疫,从而可提高抗体的整齐度。另外检测中一些显著高于平均抗体水平的结果也应引起足够重视,通常来说,这些猪只可能在过去某个阶段出现过病原感染或正处于潜伏感染状态,因而刺激猪体产生了高于常规水平的抗体。
尽管上面我们分析了母猪和公猪群中存在的CV值偏高现象,但与仔猪群相比,还是后者的CV值偏高要更为明显,其中5场仔猪CSF项的CV高达107%,其他场中仔猪各项指标的CV也均在30%以上,偏高最为显著的是CSF和PRV项,分析原因可能主要与仔猪正处于抗体水平建立的初期有关,此时受不同仔猪体内母源抗体代谢速率和自身免疫机能建立程度的差异,会表现出抗体水平的高低不齐,特别是对使用活疫苗进行免疫的疾病来说,可能更为明显。
(二)讨论
抗体检测是目前发展最成功的一项将实验室技术应用于生产指导的方法。随着近年来这方面研究投入的增大,出现了更多的既方便应用又在一定程度上能保证结果准确的新型方法,其中最有代表性的就是胶体金技术,但这类方法多是定性检测(定量的准确性有待提高),要得到更为准确的结果还是应该以ELISA(酶联免疫吸附试验)技术为主。从应用方面考虑,进行抗体检测时应该重点做好以下几个方面的工作:检测试剂盒的选择(或送检单位的选择)、采样范围及数量的确定和检测结果的分析应用。
目前国内市场上可以见到的检测试剂盒种类,从来源分,包含进口自不同国家和地区的产品和国内各科研单位及生物公司生产的产品两类;从检测原理分,可以分为针对全病原片段和部分片段两类。这些产品在价格和应用效果方面各有不同,一般认为进口产品的价格和效果都要高于国产产品,也有很多研究者进行了此类试剂盒的检测能力比较[1,2]。根据实践及与业内相关人员交流,笔者认为针对某一具体猪场和实验室来说,应该以坚持使用一种试剂盒特别是一个厂家的产品为主,尤其是在进行不同时间段测定结果间的比较时更应如此。因此检测初始试剂盒的选择非常重要,笔者建议选择时应从准确性、批次间稳定性和价格三方面进行综合比较,使用性价比最佳的产品。
检测时采集样品的范围和数量,可以根据检测目的和统计学要求结合猪场实际进行确定。如果猪场想要进行免疫效果监测或为免疫方案制定提供数据参考,则采样时要兼顾到场内的不同猪群,如后备母猪、经产母猪(怀孕和空怀)、公猪、产房仔猪、保育猪和育肥猪等,采样数量上根据李宇琴[3]和刘莲芝[4]等人报道,可以按照预定结果可信度与猪群规模进行适当确定,一般来说控制在10-30头/群即可;如果猪场在生产出现异常时,进行猪群健康状况的检测,则应重点对猪群中的发病猪和未发病猪进行分别采样,然后检测比较其差异,再结合猪群临床表现确定后续针对措施,此种情况下的采样量应该以检测需要为依据,尽可能扩大数量。
检测完成后,一般得到的数据都是简单的吸光值(OD)结果,如果要进行分析还需要对这些数据做进一步处理,因此检测人员应该首先对数据根据要求进行初步处理,然后判断单个个体的抗体状态(阴性/阳性/可疑),再计算出群体抗体合格率及离散度(即CV),最后结合送检人员提供的猪群生产信息和临床表现对猪群的健康状态及可能存在的风险做出结论并提出针对性建议。
近年来有关免疫失败的报道越来越多,笔者在临床中也发现了很多此类案列,整体来说,能够引起免疫失败的原因主要有三种:疫苗的问题、猪的问题和人的问题。对当前很多大规模猪场来说,使用的疫苗主要为进口产品和国产高端产品,饲养的猪主要为进口原种或优质杂交猪,生产人员主要为具有一定专业知识背景的高学历人员,按常理认为上述这种组合应该可以取得更好的生产成绩,但从调查来看,目前很多猪场存在高投入低产出现象,这其中很大一部分原因在于人的管理因素,本次检测的猪场有5个分场,分别由不同人员进行独立管理,从检测结果就可以看出在各项起始因素基本相同条件下不同人员的管理水平存在较大差异,所以养猪生产中,应该重点强化对人的管理,特别是对过程的管理,而不能单单依靠对结果的监控。要想实现对生产过程的合理化把控,对各项指标进行量化就是一个非常有效的手段,抗体检测技术就是能够实现对指标量化的一个准确工具。四、结论
通过本次检测,我们发现该猪场的5个分场中2场的各项抗体水平最为稳定;母猪和公猪的抗体水平要好于仔猪;PRRSV和PCV的免疫效果要好于CSF和PRV。我们建议:第一、其他分场应该加强管理,做好生产中的日常工作;第二、适当调整仔猪免疫程序,特别是CSF和PRV,建议将CSF首免时间从4w提前至3w、PRV二免时间从5w提前至4w;第三、运用一些技术性手段如饲料中添加可以增强免疫机能的中药(并可清)、免疫时添加抗应激药物(绿益态)等方法来提高猪体免疫机能,提高群体抗体整齐度。CSF首免时间从4w提前至3w是否会因母源抗体的干扰而影响免疫效果?将普免从每年3次增加到4此是否更好?——喻传洲
注:从临床应用来看,将CSF的首免时间提前至3w,不会由于干扰而影响免疫效果,且后期还要进行二免,因此整体效果可以保证;第二,也可以在采取上述措施的同时将母猪CSF的普免次数提高到4次。
参考文献:
[1] 庞然,张小敏,周斌,等. 4种商品化试剂盒检测猪瘟病毒抗体的比较分析[J].中国兽医杂志,2011,47(9):40-42.
[2] 吴延功,王志亮,王君玮,等.PRRS ELISA试剂盒检测猪繁殖与呼吸综合征病毒抗体的应用[J].中国动物检疫,2004,21(6):23-25.
[3] 李宇琴.规模化养猪场做抗体水平检测如何有效采样[J].猪业科学,2010,27(9):114.
[4] 刘莲芝,朱凤霞,罗志忠,等.猪瘟抗体监测最佳采样数量的试验研究[J].河南畜牧兽医,2008,29(19):8-9.






发表评论 取消回复